Comprender SARS-CoV-2 en humanos a partir de los coronavirus porcinos

En el cerdo se han descrito más de media docena de coronavirus distintos (Tabla 1). De todos ellos, el virus de la diarrea epidémica porcina (VDEP) ha sido el que mayor impacto ha tenido a nivel mundial. Aunque VDEP ya era endémico en Asia y Europa desde los años 1970s, han sido las cepas que emergieron en EE. UU. en 2013, actualmente descritas también en Asia y Ucrania, las que han provocado cuadros clínicos devastadores, causando la muerte de más de 8 millones de lechones en apenas un año. Independientemente de la cepa, la mortalidad disminuye con la edad siendo prácticamente nula en animales de cebo o adultos.
Tabla 1. Coronavirus del cerdo (acrónimos en inglés).
ORDEN NIDOVIRALES |
||
|
Familia |
Coronaviridae |
|
|
Subfamilia |
Coronavirinae |
|
|
Género |
Alphacoronavirus |
Alfacoronavirus entérico porcino (SeACoV) o coronavirus del síndrome de diarrea aguda porcina (SADS-CoV) |
|
Coronavirus entérico del cerdo (SeCoV) |
||
|
Coronavirus respiratorio porcino (PRCoV) |
||
|
Virus de la gastroenteritis transmisible (TGEV) |
||
|
Virus de la diarrea epidémica porcina (PEDV) |
||
|
Betacoronavirus |
Virus de la encefalomielitis hemaglutinante del cerdo (PHEV) |
|
|
Gammacoronavirus |
||
|
Deltacoronavirus |
Deltacoronavirus porcino (PDCoV) |
|
Particularidades del VDEP
El VDEP tiene un número reproductivo básico (R0) muy alto, lo cual implica que, cuando entra por primera vez en una explotación, la transmisión entre animales sea muy rápida. Ante esta situación, podríamos esperar una inmunidad de rebaño sólida y uniforme en un breve periodo de tiempo que evitara nuevas infecciones. Sin embargo, la aparición recurrente de la infección por VDEP en una granja es algo común. Uno o varios de los siguientes hechos podrían explicar este fenómeno:
- Entradas laterales periódicas de variantes/cepas distintas a las detectadas en la granja en casos anteriores, y ante las cuales no habría protección cruzada.
- Persistencia del virus en las instalaciones, lo cual facilitaría la infección de nuevos lotes o de animales nuevos en la granja.
- Infecciones subclínicas en animales de diferentes edades, especialmente en cebo y adultos, que actuarían como una fuente continua de virus.
- Existencia de subpoblaciones negativas. Estas podrían deberse a:
1) entrada de nuevos animales;
2) animales que se infectaron en edades tempranas y que con el tiempo pierden la inmunidad.
Los animales infectados por VDEP no tienen inmunidad esterilizante a largo plazo, por lo que, pasados unos meses, pueden reinfectarse, sin mostrar una clínica evidente. Estos animales actuarían como una fuente continua y silenciosa de virus, facilitando el mantenimiento del VDEP en la granja.
Así pues, una de las causas que podría explicar la presencia recurrente de VDEP en una granja es el desarrollo de una inmunidad de corta duración. Si es así, trascurrido un tiempo los animales podrían infectarse de nuevo, incluso por la misma variante del virus con la ya se habían infectado. Por tanto, conocer la duración de la inmunidad es una cuestión que había que resolver. ¿Puede la inmunidad generada durante una infección en edades tempranas ser suficiente para proteger al animal a lo largo de su vida productiva? Responder a esta pregunta nos ayudará a mejorar la gestión de la enfermedad en las granjas y, además, nos dará pistas sobre cómo aplicar una posible vacuna. Estudios previos habían descrito protección frente a la reinfección a corto plazo (un mes). Sin embargo, aunque existen algunos datos sobre la duración de los anticuerpos (estudios a seis meses tras la infección), se desconoce cuál es el nivel de protección a largo plazo.
¿Cuánto dura la inmunidad frente al coronavirus?
El objetivo que nos planteamos en nuestro estudio fue caracterizar la inmunidad frente al VDEP tras una primera inoculación y, mediante un desafío homólogo -esto es, inoculando la misma cepa que se había usado para la primera inoculación- valorar la protección a largo plazo (cinco meses). El estudio se ejecutó según el diseño experimental mostrado en la figura 1.
Figura 1. Diseño experimental para valorar la duración de la inmunidad frente al coronavirus de la DEP.
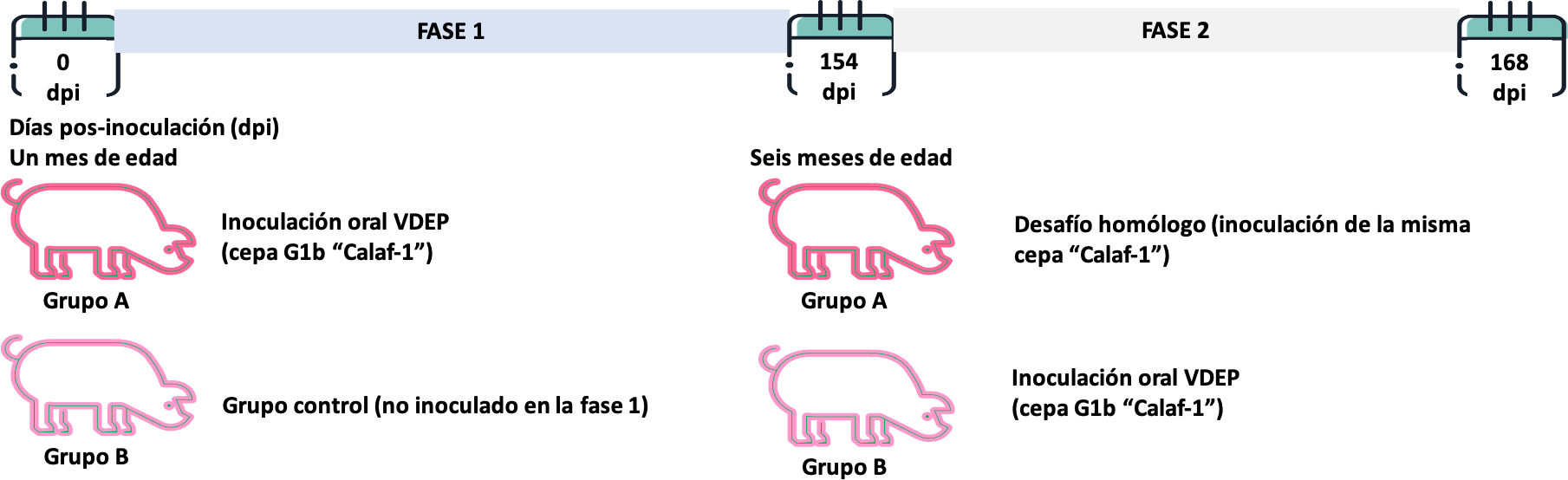
- VALORACIÓN DE LA CLÍNICA
- Consistencia de las heces (presencia de diarrea).
- ANÁLISIS VIROLÓGICOS:
- Detección del genoma del virus en heces por RT-PCR cuantitativa.
- Secuenciación de las muestras positivas.
- ANÁLISIS INMUNOLÓGICOS:
- Evaluación de la respuesta humoral:
- Detección de anticuerpos (IgG) en suero: comparación de 3 ELISAs comerciales.
- Detección de anticuerpos IgA en suero.
- Detección de anticuerpos neutralizantes en suero.
- Detección de células secretoras de IgA e IgG específicas de VDEP en sangre y linfonodos.
- Evaluación de respuesta celular en sangre y linfonodos (detección de células secretoras de IFNγ específicas de VDEP).
A continuación, se enumeran las principales conclusiones del estudio. Cabe destacar que muchas de ellas se asemejan a las que posteriormente hemos podido observar en la reciente pandemia por SARS-CoV-2 en humanos.
FASE 1:
- Excreción del virus durante 10-14 días; en algunos animales hasta un mes y medio. Aunque el tiempo medio de excreción de SARS-CoV-2 en humanos está en torno a 7-14 días, se han descrito casos de meses de duración.
- A cinco meses, se detectaron anticuerpos neutralizantes solo en el 77 % de los animales. En humanos, sabemos que la cantidad de anticuerpos neutralizantes producidos frente a SARS-CoV-2 es dependiente de la gravedad de la enfermedad; sin embargo, es a partir de los seis meses cuando estos presentan la mayor caída, independientemente de la gravedad del cuadro clínico.
- Existen grandes diferencias entre los kits comerciales para la detección de anticuerpos, especialmente en fases tardías. Aunque todos mostraron una especificidad del 100 %, uno de ellos mostró una sensibilidad inferior al 0,7. A cinco meses de la inoculación, el kit A detectó el 92 % de los positivos, el B solo el 27 % y el C ninguno. En el caso de SARS-CoV-2 también se han observado diferencias muy notables entre kits de diagnóstico serológico, especialmente en fases muy tardías.
FASE 2:
- Tras el desafío homólogo (grupo A), se observa un aumento de las respuestas inmunológicas de tipo celular y humoral, lo cual demuestra la existencia de memoria inmunológica de células T y células B.
- A pesar de la existencia de memoria inmunológica, todos los animales del grupo A se infectaron. Por tanto, la inmunidad a largo plazo no puede considerarse esterilizante.
Similitudes entre SARS-CoV-2 y VDEP
En definitiva, aun en presencia de anticuerpos neutralizantes, los animales del grupo A se infectaron por la misma variante del virus frente a la cual habían desarrollado inmunidad. Ahora bien, estos animales excretaron menos virus y por menos tiempo, y tuvieron una clínica mucho más leve que durante la primera inoculación -cuatro semanas de edad-, y que los animales que se inocularon por primera vez a los seis meses de edad (Grupo B). La memoria inmunológica, y el consiguiente booster, serían los responsables de esta protección parcial. Podríamos concluir que dicha protección favorece la reducción de la presión infectiva a nivel poblacional. Sin embargo, cabe destacar que la cantidad de virus excretado por los animales del grupo A era aún suficiente para infectar otros animales. Este fenómeno puede explicar el mantenimiento en la granja de la infección por una misma cepa de VDEP y la aparición recurrente de casos clínicos (figura 2).
Figura 2. La inmunidad generada de corta duración puede explicar el mantenimiento de la infección por VDEP en una granja.
![]()
Las similitudes con los fenómenos que hemos podido observar con la infección de SARS-CoV-2 en humanos y la eficacia de las vacunas son más que evidentes. En este último caso, habría que incluir algún factor más en la ecuación, como la protección cruzada de las vacunas con las nuevas variantes que han aparecido, o la menor virulencia de estas últimas.
Ivan Díaz, Joan Pujols, Martí Cortey, Enric Mateu, Margarita Martín.
Referencias
Díaz I, Pujols J, Cano E, Cortey M, Navarro N, Vidal A, Mateu E, Martín M. Immune response does not prevent homologous PEDV reinfection five months after the initial challenge. Transbound Emerg Dis. 2021. doi: 10.1111/tbed.14055.
Díaz I, Pujols J, Cano E, Cuadrado R, Navarro N, Mateu E, Martín M. Assessment of three commercial ELISAs for the detection of antibodies against PEDV at different stages of the immune response. Vet Immunol Immunopathol. 2021. doi: 10.1016/j.vetimm.2021.110206.

