Enfermedades, Florencia Correa Fiz
Un sospechoso habitual con una variabilidad inusual: PCV-2

El protagonista de esta historia es el virus más pequeño capaz de infectar a mamíferos que se conoce hasta el momento: el circovirus porcino 2 (PCV-2). PCV-2 es el causante de la circovirosis porcina, una enfermedad que afecta al cerdo en varias etapas productivas, especialmente a lechones post-destete e inicio de engorde. Este pequeño virus tiene un genoma que codifica para tan solo 3 proteínas principales que se encargan, por un lado, de mediar la replicación del virus (proteína Rep y Rep’) y por otro, de producir una cápside que lo envuelve (proteína Cap). Es esta proteína Cap, la que es reconocida por el sistema inmunológico y es capaz de inducir una respuesta de anticuerpos (humoral) y celular efectiva.
Con tan solo estas funciones codificadas en su genoma, este virus fue capaz de provocar inmensas pérdidas económicas en el sector porcino a principios de este siglo. La llegada de una vacuna altamente eficaz a principios del 2000 fue la que puso freno a este desastre, afortunadamente, aunque la fortuna no tuvo nada que ver, sino los excelentes científicos que estuvieron involucrados en su desarrollo.
PCV-2 no se ha “quedado quieto” desde entonces. Con una capacidad de variación excepcionalmente alta, se han detectado hasta 9 genotipos de PCV-2. Estos genotipos no son otra cosa que genomas víricos con una similitud genética suficientemente alta como para ser el mismo virus, pero lo suficientemente baja como para dividirlos en grupos diferentes. Pues bien, hemos sido testigos de dos grandes cambios en la prevalencia de estos genotipos, siendo el genotipo más frecuente PCV-2a a finales de los 90, para pasar a ser PCV-2b a principios de los 2000 y, más recientemente, PCV-2d ha demostrado ser el más prevalente mundialmente.
Desde entonces, este pequeño agente se ha vuelto una vez más un sospechoso habitual en aquellas granjas donde se detectan problemas de desmedro a pesar de que se vacune contra PCV-2. Se ha sugerido que el cambio de genotipo podría ser la causa de estos casos, sin embargo, los estudios apuntan a que las vacunas disponibles en el mercado (basadas en PCV-2a) confieren también protección contra este nuevo genotipo.
En este contexto de cambios en la prevalencia global de genotipos, entender los factores que contribuyen a esta dinámica y los mecanismos asociados (evolución molecular) se vuelve esencial para aprender a controlarla. Dicho en otras palabras, entender qué es lo que favorece la aparición de estas mutaciones que dan lugar a los distintos genotipos nos podría permitir establecer pautas – o modificar las que utilizamos – para tenerlas bajo control.
Pero ¿por qué queremos tenerlas “bajo control”? La alta variabilidad de un virus dentro del organismo que lo aloja (huésped) puede representar una estrategia efectiva para la persistencia del virus dentro del animal, al mismo tiempo que le confiere la posibilidad de generar variantes capaces de amplificarse cuando el entorno cambia.
Hace algunos años, en una infección experimental con PCV-2, describimos la presencia de animales que albergaban virus con una variabilidad sorprendentemente alta, a los que denominamos “hipermutantes”. Estas modificaciones se acumulaban en la región codificante de la proteína Cap, sugiriendo que el virus intenta modificar esta proteína como estrategia para escapar a la respuesta inmunológica que lo había reconocido. Este tipo de animales aparentemente sanos (sub-clínicos) podrían actuar como incubadores y amplificadores de nuevas variantes, que a su vez podrían ser seleccionadas y transmitidas, representando un alto riesgo para la granja en cualquier momento.
Un sospechoso que debemos mantener controlado
¿Qué factores contribuyen a la aparición de estos huéspedes tan silenciosos como potencialmente peligrosos? Para responder a esta pregunta analizamos la aparición en el tiempo de variantes de PCV-2 en animales infectados naturalmente en distintas granjas.
En general, la dinámica fue fluctuante con aparición y desaparición de mutaciones de manera transitoria. Los cambios observados no eran iguales entre las diferentes granjas analizadas, pero aquellos que producían cambios en la proteína Cap se encontraban mayoritariamente en regiones expuestas en la partícula vírica – las que interaccionarían con el sistema inmune del huésped -, validando una vez más el papel central en que tiene la inmunidad en la evolución de este virus.
Tanto por la posibilidad de la aparición de animales hipermutantes como por la co-infección con distintos genotipos, este virus continúa representando un riesgo para la granja.
Uno de los hallazgos que más nos llamó la atención lo encontramos al analizar las secuencias de PCV-2 provenientes de una granja donde se mezclaban animales de distintos orígenes. Allí observamos co-infección con distintos genotipos en todos los animales analizados casi inmediata después de la mezcla, incrementándose la posibilidad de recombinación genética. En otras palabras, al infectarse el mismo animal con virus de diferentes genotipos, existe la posibilidad de que sus genomas se combinen, generándose nuevas variantes con potencial desconocido (recombinación genética). Curiosamente, en todos los eventos de co-infección donde se detectaba PCV-2d, era éste el genotipo que permanecía en el tiempo dominando sobre los otros, sugiriendo que este genotipo podría estar asociado con mayor persistencia (Figura 1). Con todo esto, se demuestra una vez más, la importancia de reducir la circulación de PCV-2 en granja, pues sigue siendo un sospechoso que debemos mantener controlado ya que, aun pasando desapercibido, puede estar actuando silenciosamente.
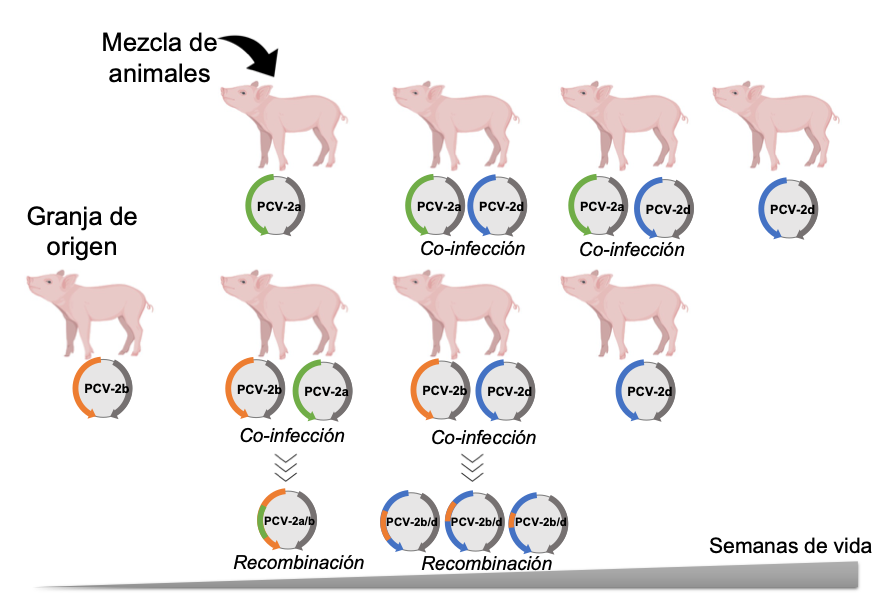
Figura 1. Esquema representativo de los diferentes genotipos detectados en animales estudiados durante 4 semanas consecutivas (Correa-Fiz et al. 2018). Todos los animales provienen de una granja infectada con PCV-2b (granja de origen), que son mezclados con animales de diversos orígenes alrededor de las 11 semanas de vida (mezcla de animales). En los casos donde se detectó la presencia de distintos genotipos en el mismo animal (co-infección), se representan los mutantes que se predicen in-silico que podrían generarse (recombinación).
Inmunidad frente a PCV2, una historia de éxito
El uso de vacunas en PCV-2 es quizás una de las mayores historias de éxito en vacunas veterinarias; sin embargo, está claro que las vacunas no reemplazan los buenos programas de bioseguridad que se deben mantener en todos los casos. Minimizar la mezcla de animales de distintos orígenes y potenciar un sistema inmunológico sólido y estimulado (calostro, pre- y probióticos, microbiota madura, programas de vacunación completos…) desde etapas tempranas, son estrategias imprescindibles a tener en cuenta.
Aun considerando todo lo anterior, debido a las características intrínsecas de este virus, debemos mantenernos siempre alertas. La prevalencia predominante actual de PCV-2d podría indicar que nos encontramos en un nuevo escenario que requiere muevas medidas. Por ende, el uso de vacunas que combinen distintos genotipos, capaces de preparar al sistema inmunitario para un reconocimiento más amplio (multivalentes) promete ser un buen camino para el control de este virus tan variable.
Un diagnóstico preciso, junto con un seguimiento cercano de las características de los virus circulantes (genotipado), son esenciales para estar preparados para una respuesta rápida que nos permita controlar eficazmente la evolución de este patógeno y, disminuir así, la gran amenaza que ésta implica.
Referencias
Correa-Fiz, F., Franzo, G., Llorens, A. et al. Porcine circovirus 2 (PCV-2) genetic variability under natural infection scenario reveals a complex network of viral quasispecies. Sci Rep 8, 15469 (2018). https://doi.org/10.1038/s41598-018-33849-2
Correa-Fiz, F., Franzo, G., Llorens, A. et al. Porcine circovirus 2 (PCV2) population study in experimentally infected pigs developing PCV2-systemic disease or a subclinical infection. Sci Rep 10, 17747 (2020). https://doi.org/10.1038/s41598-020-74627-3

