Enfermedades, Javier Martinez Lobo, Prevención
¿sabemos interpretar los resultados serológicos frente al prrsv?

El diagnóstico de las enfermedades infecciosas se puede dividir, a grandes rasgos, en un diagnóstico directo, es decir, en la detección del agente causal, y en un diagnóstico indirecto, mediante la detección de anticuerpos generados por el hospedador tras la infección. Para interpretar los resultados diagnósticos debemos comprender:
- qué sistema estamos utilizando,
- qué limitaciones tiene la técnica seleccionada y
- cuáles son las características intrínsecas de la enfermedad estudiada.
En este pequeño post, hablaremos someramente del diagnóstico serológico del Síndrome reproductivo y respiratorio porcino (PRRS) y de sus pros y sus contras.
Diagnóstico del virus PRRS
En el caso del PRRS la detección de anticuerpos frente al virus se puede realizar mediante diferentes técnicas entre las que destacan el ensayo ELISA (inmunoabsorción ligada a enzimas) y el ensayo de seroneutralización (SN). Este último es capaz de detectar anticuerpos con funcionalidad biológica, que son capaces de bloquear la infectividad del virus. Por ello, los anticuerpos neutralizantes (AN) se han relacionado con la protección frente a reinfecciones1. No obstante, la técnica de SN necesita una logística de laboratorio más compleja, un personal más especializado y poseer la cepa sobre la que se quiere saber el título de AN adaptada a cultivo celular. Estas desventajas hacen que no sea una técnica disponible en la mayoría de los laboratorios de diagnóstico y que se use fundamentalmente en el campo de la investigación.
La técnica más utilizada en la actualidad para la determinación de la respuesta inmunitaria humoral es la técnica de ELISA. Esta técnica tiene una serie de ventajas frente a las otras técnicas de detección de anticuerpos como son:
- su fácil estandarización,
- la posibilidad de realización por casi todos los laboratorios de diagnóstico y
- su precio relativamente económico.
No obstante, hemos de tener en cuenta que los anticuerpos generados por las vacunas comerciales son indistinguibles de los generados por la infección natural, por lo tanto, no podemos distinguir animales vacunados de animales infectados. Esto se debe a que, a pesar de los esfuerzos realizados por los grupos de investigación para desarrollar vacunas marcadas (a los cuales les falta una proteína o un epítopo), hasta la fecha no se ha logrado este objetivo debido a la naturaleza tan plástica y variable del PRRSV.
Por otra parte, la mayor parte de los ensayos de ELISA utilizados no permiten la cuantificación del título de anticuerpos, por lo que únicamente nos permiten dar resultados de negativo/positivo para cada muestra.
Además, los anticuerpos detectados por la técnica ELISA no tienen por qué tener un papel en la protección, ya que en muchos casos se detectan anticuerpos frente a la proteína de la nucleocápside(N) que no tienen actividad neutralizante.
Se recomienda ser consciente de qué ELISA se está utilizando, su sensibilidad y especificidad y qué resultados estamos obteniendo en el campo.
En consecuencia, únicamente nos permiten confirmar si un animal se ha infectado o no. En este sentido, podemos observar en la Tabla 1 cómo los valores S/P ratio (relación entre la muestra y el positivo del test) de un ELISA comercial no se relacionan directamente con la capacidad neutralizante de esos mismos sueros.
Tabla 1. Resultados de ELISA (S/P Ratio) y SN en cerdas de reposición tras su adaptación.
|
Animal |
S/P ratio |
Título AN |
|
1 |
0,85* |
1/4 |
|
2 |
1,75 |
Negativo |
|
3 |
1,62 |
1/16 |
|
4 |
1,39 |
1/32 |
|
5 |
2,80 |
Negativo |
|
6 |
1,13 |
1/8 |
|
7 |
0,48 |
Negativo |
|
8 |
1,96 |
1/32 |
|
9 |
1,52 |
1/4 |
|
10 |
3,27 |
1/8 |
*: Valores >0,4 son considerados positivos
Por último, la variabilidad de la respuesta de cada individuo a los epítopos del virus vacunal y los diferentes ensayos de ELISA que existen en el mercado pueden tener influencia en que la detección de anticuerpos sea más temprana o incluso en que haya una proporción de animales seronegativos aun estando vacunados. Por ello, se recomienda ser consciente de qué ELISA se está utilizando, su sensibilidad y especificidad y qué resultados estamos obteniendo en el campo2. Sin embargo, el uso de la técnica ELISA es de mucha ayuda en varias situaciones.
Situaciones en las que la técnica ELISA es una buena opción
1) Diagnóstico de la infección en animales seronegativos.
Esto es especialmente interesante en granjas libres de la enfermedad. No obstante, ante la importancia de un diagnóstico rápido de las explotaciones libres de PRRSV, que en muchos casos son granjas de genética, se ha impuesto el diagnóstico molecular por RT-qPCR que detecta la infección de forma más temprana.
2) Detección de anticuerpos en animales en crecimiento.
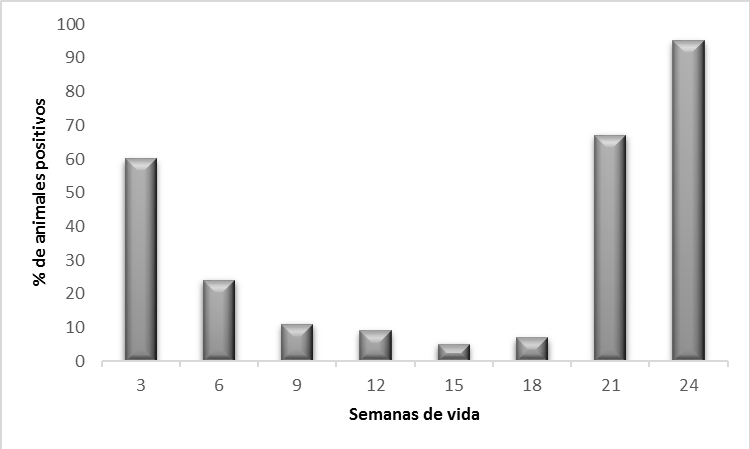
La detección de anticuerpos en animales en crecimiento se utiliza fundamentalmente para la realización de seroperfiles (Fig 1.). Así podremos determinar cómo de duradera es la inmunidad materna en los animales y en qué momento se está produciendo la circulación del virus, y así poder implementar las mejores medidas de control. Para ello debemos conocer el tiempo de seroconversión tras la infección que, aunque depende del ELISA utilizado, suele encontrarse entre las 2-3 semanas. Finalmente, hay que destacar que en las granjas en donde se realiza la vacunación de lechones−cada vez más frecuente en casi todos los países productores de porcino−la serología de estos animales tiene una menor utilidad ya que los animales serán seropositivos debido a la vacunación.
Figura 1. Seroperfil de una granja positiva con circulación vírica al final del engorde.
3) Cerdas de reposición.
En las cerdas de reposición de origen negativo, el uso de la técnica ELISA es fundamental para confirmar que se han realizado con éxito el periodo de cuarentena y el de adaptación. Así, las cerdas deben llegar seronegativas a nuestra granja y tras la adaptación al PRRSV (mayoritariamente mediante vacunación con vacunas MLV) deben ser seropositivas como prueba de que se han inmunizado correctamente. Por último, es importante señalar que para monitorizar el estado de las cerdas de reposición necesitamos también del diagnóstico directo mediante RT-qPCR para estar seguros de que este proceso se lleva a cabo correctamente, ya que los animales no deben ser virémicos cuando los introduzcamos al ciclo productivo.
¿Es útil la serología del PRRSV en cerdas reproductoras en granjas infectadas de forma endémica?
La determinación de anticuerpos frente a PRRSV en las cerdas en producción cuando estamos en situaciones de infección endémica y donde se realizan vacunaciones sistemáticas al efectivo reproductor tiene varias limitaciones que hacen que su uso no sea aconsejable. En primer lugar, como ya hemos dicho, no podemos diferenciar animales vacunados de infectados, por lo que el diagnóstico de un brote es complicado utilizando únicamente la serología. Por otro lado, la respuesta secundaria, que se usa con frecuencia en otras enfermedades para determinar una reinfección, tiene un escaso valor en el caso del PRRSV ya que esta respuesta secundaria no siempre se produce y es dependiente de la combinación específica de cepas de la que se trate3. Además, cuando se produce es muy rápida y, en ocasiones, ya ha sucedido cuando se toma la primera muestra.
Además, la respuesta humoral medida mediante ELISA frente a diferentes cepas del virus es bastante diversa3, por lo que un aumento en los valores S/P ratio no siempre se producen de manera clara e intensa tras una reinfección.
Por último, la aplicación de dosis repetidas de una vacuna suele conducir a una respuesta secundaria de muy baja intensidad, pudiendo llegar los animales incluso a ser seronegativos4.
Conclusiones
En el caso del PRRS, la serología es útil para establecer si una granja negativa se ha infectado; para monitorizar el estatus de las cerdas de renovación en la cuarentena y la adaptación; y para conocer en qué momento se produce la circulación vírica en animales en crecimiento. Sin embargo, en granjas positivas y que realizan vacunaciones sistemáticas el uso de la serología no es recomendable para determinar si se han producido reinfecciones en el efectivo reproductor.
Referencias:
1. Martínez-Lobo FJ, Díez-Fuertes F, Simarro I, Castro JM, Prieto C. (2021) The Ability of Porcine Reproductive and Respiratory Syndrome Virus Isolates to Induce Broadly Reactive Neutralizing Antibodies Correlates With In Vivo Protection. Front Immunol. 12:691145. doi: 10.3389/fimmu.2021.691145.
2. Maiques E, Abadias J, López J, Llavat Jerez, CT. (2021). Measuring the immune response of PRRS “naïve” gilts after vaccination with different ELISA kits. Proceedings of 12th European Symposium of Porcine Health and Management pp 95.
3. Kim WI, Lee DS, Johnson W, Roof M, Cha SH, Yoon KJ. (2007). Effect of genotypic and biotypic differences among PRRS viruses on the serologic assessment of pigs for virus infection. Vet Microbiol. 123(1-3):1-14. doi: 10.1016/j.vetmic.2007.03.007.
4. Díaz I, Genís-Jorquera B, Martín-Valls GE, Mateu E. (2020). Using commercial ELISAs to assess humoral response in sows repeatedly vaccinated with modified live porcine reproductive and respiratory syndrome virus. Vet Rec. 186:123. doi: 10.1136/vr.105432.

