Enfermedades, Prevención, Zona Porcino
¿Cómo influye la variabilidad genética del PCV2 en la prevención de la enfermedad?

El circovirus porcino tipo 2 (PCV2) es un virus ubicuo de ADN monocatenario en los cerdos y agente causal de la denominada Enfermedad por Circovirus Porcino (PCVD) que puede manifestarse como infección clínica (PCV2-SD) o subclínica (PCV2-SI). La infección subclínica es la forma más común del resultado de la infección por PCV2, lo que provoca una disminución de la ganancia media diaria (GMD) sin signos clínicos evidentes y, en consecuencia, importantes pérdidas económicas.1
También se ha descrito la enfermedad reproductiva asociada a circovirus porcino tipo 2 (PCV2-RD), que se caracteriza por:
- abortos tardíos,
- nacidos muertos,
- lechones nacidos débiles y momificaciones similares a las de la infección por parvovirus porcino,
- así como muertes embrionarias tempranas.2
Variabilidad genética del PCV2
Hay 8 genotipos propuestos de PCV2 clasificados como PCV2a a PCV2h. Los distintos genotipos de PCV2 son genéticamente similares conteniendo dos proteínas estructurales principales: la replicasa codificada por la ORF1 y la cápside codificada por la ORF2. Es notable que este virus ADN tenga una tasa evolutiva más parecida a la de los virus ARN. La coinfección con virus PCV2 es común, lo que puede conducir a la interacción intracelular de múltiples virus PCV2 permitiendo más oportunidades para que ocurra una variación genética. La recombinación sucede en el 20-35 % de los virus PCV2 y se ha observado en la mayoría de los genotipos.3
Según un estudio retrospectivo llevado a cabo por M. Sibila et al. en 2021, los casos de PCV2-SD diagnosticados entre 2009 y 2020 provenientes de 50 granjas vacunadas frente a PCV2 estaban asociados tanto al genotipo PCV2b como PCV2d. Aunque la frecuencia general de detección de estos dos genotipos en este marco fue muy similar, su distribución temporal fue diferente. Mientras que PCV2b se encontró desde 2009 a 2017, PCV2d fue reportado desde 2013 a 2020. Esta tendencia de reemplazo del PCV2b por PCV2d está respaldada por los resultados obtenidos en otros países productores de cerdos donde se ha revelado un incremento de la detección de PCV2d.4
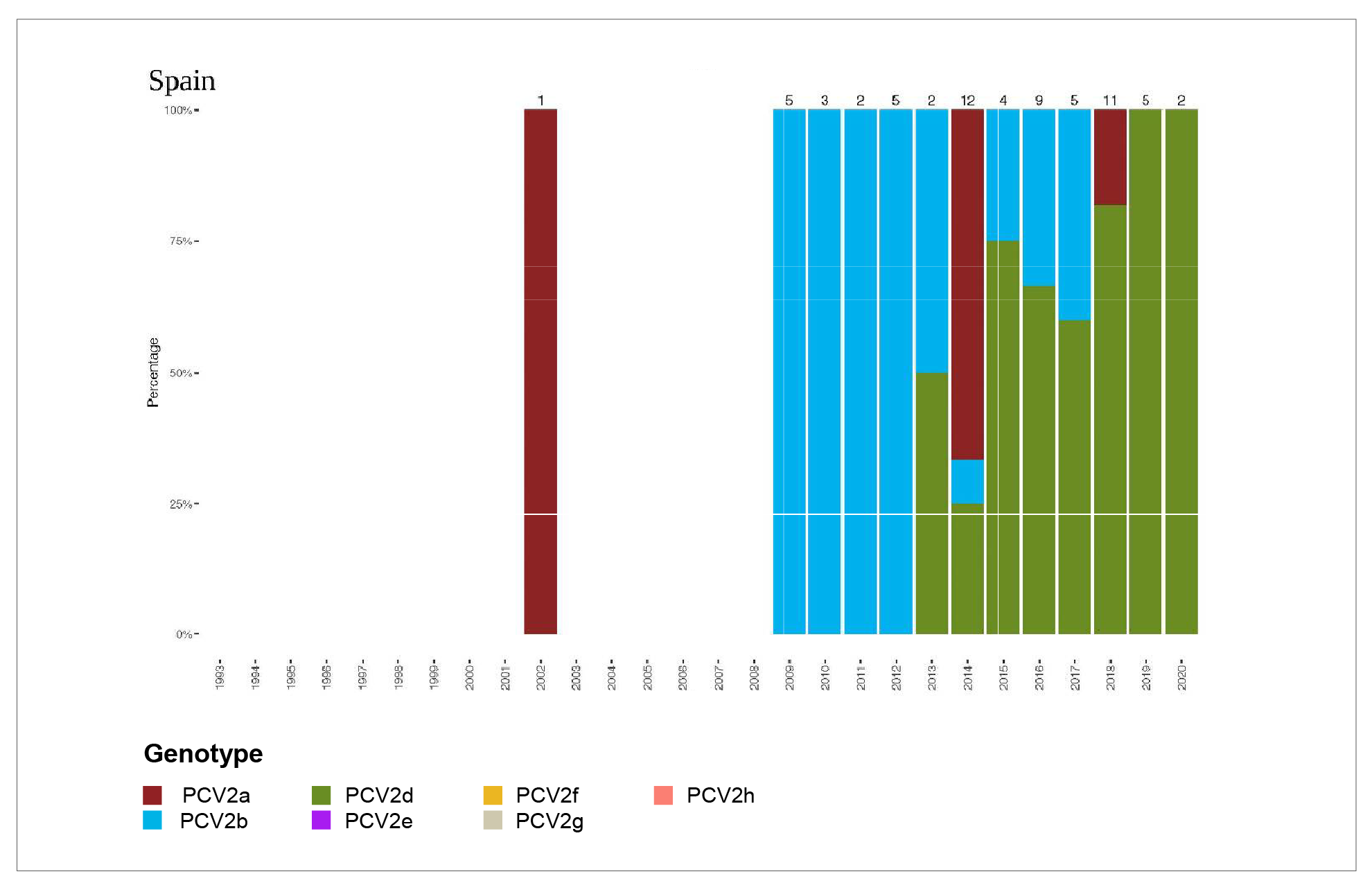
Figura 1. Patrón de frecuencia de los genotipos de PCV-2 en España (entre 2009 y 2020).4
Diagnóstico
A pesar del hecho de que las vacunas frente a PCV2 son muy eficientes, no son perfectas, y pueden prevenir la enfermedad clínica pero no la infección. Por lo tanto, una proporción de animales vacunados se siguen infectando durante el periodo de producción. Considerando que la base genética del cerdo es importante para la expresión de la PCV2-SD y la carga viral en suero, es muy probable que una determinada carga viral no tenga las mismas consecuencias en el rendimiento dependiendo de los individuos, líneas genéticas o razas.5
La combinación de cepas vacunales de PCV2b y PCV2a en una vacuna proporciona un virus vacunal representativo para cada uno de los principales grupos de PCV2
Aunque la vacunación frente a PCV2 ha reducido drásticamente el impacto de las enfermedades asociadas al circovirus porcino, el diagnóstico de la enfermedad sistémica por PCV2 (PCV2-SD) todavía se establece ocasionalmente. Los criterios para el diagnóstico de PCV2-SD incluyen:
- la presencia de signos clínicos compatibles con la enfermedad (retraso en el crecimiento, desmedro, y signos clínicos respiratorios y/o digestivos),
- la observación de lesiones histológicas características en los tejidos linfoides (depleción linfocitaria, infiltración histiocítica, y la presencia de células multinucleadas y/o con inclusiones intracitoplasmáticas),
- juntamente con la detección de una cantidad moderada a marcada de PCV2 en los tejidos dañados.4 Recientemente, un trabajo ha propuesto 109 copias del genoma viral por gramo de tejido cardiaco fetal como indicativo del diagnóstico de la PCV2-RD (enfermedad reproductiva asociada a circovirus porcino tipo 2).2
Prevención de la enfermedad
Las vacunas PCV2a pueden brindar protección cruzada frente PCV2d en condiciones experimentales, pero la emergencia de PCV2d se sigue relacionando con brotes de enfermedad asociada a PCV2 en cerdos vacunados con PCV2a.6
La emergencia de PCV2d se sigue relacionando con brotes de enfermedad asociada a PCV2 en cerdos vacunados con PCV2a
El éxito de las vacunas de PCV2a en la reducción de la enfermedad clínica frente una variedad de cepas de campo se debe, en gran parte, a los epítopos comunes compartidos entre un amplio número de genotipos de campo y las vacunas basadas en PCV2a existentes. Sin embargo, a medida que se acumulan cambios menores en la secuencia de la cápside, los epítopos compartidos entre las vacunas basadas en PCV2a y las cepas de campo van disminuyendo. Incluso cambios menores en la secuencia de aminoácidos de la cápside pueden alterar la configuración de epítopos conformacionales y, por lo tanto, afectar a la patogenicidad y a la diferenciación inmunitaria de PCV2, incluida la unión de anticuerpos neutralizantes.3
La combinación de cepas vacunales de PCV2b y PCV2a en una vacuna proporciona un virus vacunal representativo para cada uno de los principales grupos de PCV2 (PCV2a y PCV2b/d)3 y expande los epítopos incluidos en la vacuna en un 33 % según los estudios existentes.6
Esta predicción de cobertura mejorada en comparación con las vacunas monovalentes basadas en PCV2a es especialmente evidente frente a PCV2b, así como PCV2d. La mayor cobertura ofrecida frente a PCV2d basada en la adición de PCV2b está respaldada por la mayor identidad de la secuencia y la conservación de epítopos experimentales entre PCV2b y PCV2d en comparación con PCV2a y PCV2d respectivamente.7
En definitiva, la actualización de las vacunas tradicionales frente PCV2 incluyendo múltiples genotipos puede inducir una protección mayor y más completa, así como potencialmente ralentizar la evolución del diverso y cambiante virus PCV2.
Referencias
1. Pleguezuelos P, Sibila M, Ramírez C, et al. Efficacy Studies against PCV-2 of a New Trivalent Vaccine including PCV-2a and PCV-2b Genotypes and Mycoplasma hyopneumoniae When Administered at 3 Weeks of Age. Published online 2022. doi:10.3390/vaccines10122108
2. Unterweger C, Brunthaler R, Auer A, Fux R, Weissenbacher-Lang C, Ladinig A. Reconsideration of the diagnostic criteria required for PCV2 reproductive disease. Veterinary Journal. 2021;272. doi:10.1016/j.tvjl.2021.105660
3. Bandrick M, Balasch M, Heinz A, et al. A bivalent porcine circovirus type 2 (PCV2), PCV2a-PCV2b, vaccine offers biologically superior protection compared to monovalent PCV2 vaccines. Vet Res. 2022;53(12). doi:10.1186/s13567-022-01029-w
4. Sibila M, Rocco C, Franzo G, et al. Genotyping of Porcine Circovirus 2 (PCV-2) in Vaccinated Pigs Suffering from PCV-2-Systemic Disease between 2009 and 2020 in Spain. Published online 2021. doi:10.3390/pathogens10081016
5. Schwarz L, Segalés J, Sibila M. Revisiting Porcine Circovirus Disease Diagnostic Criteria in the Current Porcine Circovirus 2 Epidemiological Context. Published online 2022. doi:10.3390/vetsci9030110
6. Um H, Yang S, Oh T, et al. Comparative Evaluation of Growth Performance between Bivalent and Trivalent Vaccines Containing Porcine Circovirus Type 2 (PCV2) and Mycoplasma hyopneumoniae in a Herd with Subclinical PCV2d Infection and Enzootic Pneumonia. Vaccines (Basel). 2021;9(450). doi:10.3390/vaccines9050450
7. Bandrick M, Gutiérrez AH, Desai P, et al. T cell epitope content comparison (EpiCC) analysis demonstrates a bivalent PCV2 vaccine has greater T cell epitope overlap with field strains than monovalent PCV2 vaccines. Vet Immunol Immunopathol. 2020;223. doi:10.1016/J.VETIMM.2020.110034




