Enfermedades, Manejo, Mercados, Zona Porcino
Complejo de Poliserositis Porcina: claves para un diagnóstico laboratorial preciso y eficaz

El Complejo de Poliserositis Porcina es una enfermedad que afecta de manera significativa a la producción porcina, con un impacto especialmente notable en lechones durante la fase postdestete. Esta patología multietiológica es causada por un conjunto de patógenos, entre los que se incluyen Glaesserella parasuis (G. parasuis), Streptococcus suis (S. suis), Mycoplasma hyorhinis (M. hyorhinis) y Actinobacillus suis (A. suis). Dado que los signos clínicos y las lesiones observadas en necropsia son comunes entre estos patógenos, un diagnóstico laboratorial preciso se convierte en un elemento esencial para la implementación de un tratamiento eficaz y la adopción de medidas de control adecuadas que minimicen el impacto negativo de esta enfermedad a nivel productivo y económico en las granjas porcinas.
El diagnóstico laboratorial es fundamental, pero debe complementarse siempre con la historia clínica de la granja y el criterio clínico del veterinario. El aislamiento correcto de los microorganismos permite realizar pruebas adicionales, como la sensibilidad antimicrobiana y la tipificación, indispensables para un control efectivo de la enfermedad. Sin embargo, el cultivo y aislamiento de las bacterias causantes son extremadamente complicados, por lo que un resultado negativo no debe considerarse definitivo, ni un diagnóstico positivo como confirmatorio. Además, una vez instaurado un tratamiento específico, es vital evaluar su éxito para validar o ajustar el proceso diagnóstico previamente realizado, asegurando una metodología más precisa en casos futuros.
En este contexto, ¿Cuál es el paso a paso para el diagnóstico del Complejo de Poliserositis Porcina?
|
Diagnóstico laboratorial del Complejo de Poliserositis Porcina |
||
|
Paso 1 |
SELECCIÓN DE INDIVIDUOS |
Condición: no medicados |
|
Criterio de selección: dos lechones con signos clínicos agudos |
||
|
Momento de muestreo: fin de lactancia hasta cebo (cuando se observe sintomatología clínica aguda) |
||
|
Paso 2 |
TOMA DE MUESTRAS |
Ubicación: realizar en lesiones sistémicas |
|
Asepsia: buscar mantener condiciones de asepsia |
||
|
Paso 3 |
TRANSPORTE DE MUESTRAS AL LABORATORIO |
Plazo: < 48hs posteriores a toma de muestras |
|
Temperatura: 4 - 8ºC |
||
|
Envío: utilizar recipientes originales empleados en la recolección |
||
|
Paso 4 |
SELECCIÓN DEL MÉTODO DE DIAGNÓSTICO |
Técnica 1: cultivo y aislamiento |
|
Técnica 2: PCR |
||
Paso 1: Selección de individuos
La correcta elección de los animales a muestrear es fundamental para obtener resultados representativos y precisos de la realidad productiva de cada granja. Esta selección debe centrarse en los siguientes puntos:
- Utilizar camadas sin medicar: para observar la patogenia real de la enfermedad, se recomienda utilizar camadas de primerizas en las que ni la cerda ni los lechones hayan sido medicados desde el nacimiento. Se debe evitar la selección de animales tratados con antibióticos para no interferir en la identificación de los patógenos en el laboratorio.
- Centrar el estudio en dos lechones: para la posterior toma de muestras, seleccionar los dos primeros lechones que presenten signos clínicos agudos, como fiebre, pérdida de apetito, inicio de pérdida de condición corporal, tos, disnea o inflamación de articulaciones.
- Elección de momento adecuado de muestreo: el momento ideal para la toma de muestras depende del patógeno involucrado y puede variar desde el final de la lactancia hasta la fase de cebo, siempre bajo la premisa de realizar la recolección cuando se observen cerdos con signos clínicos agudos.
Paso 2: Toma de muestras
La correcta toma de muestras es clave para lograr un diagnóstico laboratorial eficaz. Dado que las bacterias implicadas en este complejo son comunes en la mayoría de las granjas, es esencial diferenciar entre las bacterias patógenas y las apatógenas que residen naturalmente en los cerdos.
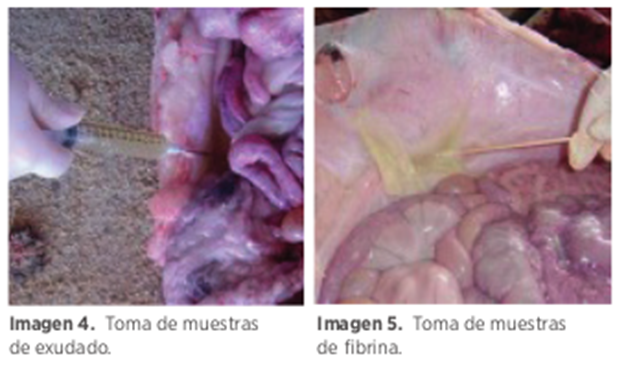
- Muestras de lesiones sistémicas: deben ser tomadas de lesiones identificadas durante la necropsia, como líquido articular en casos de artritis, líquido pericárdico en casos de pericarditis y exudado de la cavidad torácica o abdominal en casos de pleuritis y peritonitis.
- Mantenimiento de asepsia: realizar la toma de muestras de forma aséptica es esencial para evitar la contaminación, utilizando jeringuillas o vacutainers si la cantidad de exudado lo permite, e hisopos para muestras directas en serosas fibrinosas. Si no es posible mantener la asepsia, se recomienda enviar al lechón entero al laboratorio, preferiblemente sacrificado y desangrado sin alterar los órganos internos, o vivo en cajas de transporte específicas para esta actividad.
Cabe destacar que la toma de un elevado número de muestras aumenta la probabilidad de éxito en detectar las bacterias buscadas.
Paso 3: Transporte de muestras al laboratorio
El transporte de las muestras al laboratorio debe realizarse lo antes posible, idealmente dentro de las 48 horas posteriores a su recolección. Es crucial mantener las muestras refrigeradas entre 4 y 8°C durante el transporte para preservar la viabilidad de las bacterias, evitando tanto la congelación como la exposición a temperaturas elevadas. Además, las muestras deben enviarse en los recipientes originales, ya sean jeringuillas o hisopos, siendo recomendable en este último caso su colocación en un medio de transporte como Amies.
Paso 4: Selección del método de diagnóstico
El último paso es seleccionar las técnicas diagnósticas más adecuadas para identificar los patógenos sospechosos. Aunque no existe una técnica perfecta, la combinación de métodos como el aislamiento bacteriano y la PCR resulta altamente efectiva. La PCR permite la obtención de resultados rápidos, mientras que el aislamiento bacteriano es esencial cuando se requiere la caracterización de las cepas presentes, como su susceptibilidad antimicrobiana y su tipificación.
|
Cultivo y aislamiento |
PCR |
||
|
Streptococcus suis |
Ventajas |
Definitivo y sencillo |
|
|
Inconvenientes |
Necesidad de toma de muestra estéril |
||
|
Glaesserella parasuis |
Ventajas |
Resultado positivo es definitivo |
No requiere la bacteria con vida |
|
Inconvenientes |
Posibilidad de falsos negativos |
||
|
Mycoplasma hyorhinis |
Ventajas |
Mejor crecimiento que otros micoplasmas |
Sencillo y validado |
|
Inconvenientes |
Posibilidad de contaminaciones y falsos negativos |
||
|
Actinobacillus suis |
Ventajas |
Permite diferencial con otros Actinobacillus |
No requiere la bacteria con vida |
|
Inconvenientes |
Cultivo muy exigente |
Posibilidad de confusión con otras bacterias |
|
Conclusión
Un diagnóstico certero del Complejo de Poliserositis Porcina requiere un enfoque integral que combine observación clínica, toma precisa de muestras, adecuado transporte y selección de métodos diagnósticos apropiados. Solo así es posible implementar medidas efectivas para controlar esta enfermedad y minimizar su impacto en las granjas porcinas.
Referencias
- Abadías, J.; Claver, M.; Macarrilla, J.; Maiques, E. (2013). Antibióticos de larga acción en el control del complejo de la poliserositis fibrinosa. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=4471302
- Maschi, A.; Amanto, F.; Riccio, M. (2022). Enfermedad de Glasser en una granja comercial de ciclo completo: presentación de caso clínico. Disponible en: https://ridaa.unicen.edu.ar:8443/server/api/core/bitstreams/c6249e1c-b0a4-4937-9c96-d4ed137e130e/content
- Kang, I.; Kim, D.; Han, K.; Seo, H.; Oh, Y.; Park, C.; Lee, J.; Gottschalk, M.; Chae, C. (2012). Optimized protocol for multiplex nested polymerase chain reaction to detect and differentiate Haemophilus parasuis, Streptococcus suis, and Mycoplasma hyorhinis in formalin-fixed, paraffin-embedded tissues from pigs with polyserositis. Canadian journal of veterinary research, 76(3), 195-200. Disponible en: https://www.ingentaconnect.com/content/cvma/cjvr/2012/00000076/00000003/art00006
- Olvera, A.; Segalés, J.; Aragón, V. (2007). Update on the diagnosis of Haemophilus parasuis infection in pigs and novel genotyping methods. The Veterinary Journal, 174(3), 522-52. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S1090023306002334
- Zoetis. Ebook – Complejo de Poliserositis Porcina.
- Zoetis. Blog – Proyecto “Diagnóstico de la poliserositis porcina”. Disponible en: https://www2.zoetis.es/productos-y-soluciones/porcino/servicios-porcino




